
Новый Эталон Килограмма
может в ближайшее время заменить устаревший платиново-иридиевый... »»»

Солнце Становится Ближе
получены изображения высокого разрешения Солнца с космической обсерватории Solar Dynamics Observatory... »»»

Человек "Искрививший" Время
биография Альберта Эйнштейна - величайшего физика создавшего "Общую теорию относительности"... »»»

Что за Очки у Будущего?
история создания, развития и будущее популярного оптического прибора... »»»
 Три закона для газов могут быть объединены в закон, известный как объединенный газовый закон:
Три закона для газов могут быть объединены в закон, известный как объединенный газовый закон:
pV/T = const или p1V1/T1 = p2V2/T2
При постоянной температуре Т1 = Т2 и p1V1 = p2V2 - закон Бойля. При постоянном объеме V1 = V2 и p1/T1 = p2/T2 - закон давления. При постоянном давлении p1 = р2 и V1/T1 = V2/T2 - закон Шарля.
Важно помнить, что масса газа всегда остается постоянной. Изменение массы газа приведет к изменению числа молекул на единицу объема.
Пример
Шар объемом 0,5 м3, содержащий водород при давлении 2 х 105 Па, отпущен земли, когда температура составляет 17 °С. Каков будет его объем, когда он достигнет высоты, на которой давление внутри шара равно 1,5 х 105 Па, а температура составит 6 °С?
исходное давление р1 = 2 х 105 Па
исходный объем V1 = 0,5 м3
исходная температура Т1 = 17+273= 290 К
конечное давление р2 = 1,5 х 105 Па
конечный объем V2 = ?
конечная температура Т2 = 6 + 273 = 279 К (нужно перевести температуру в Кельвин).
Согласно объединенному газовому закону: ((2 х 105) Па х (0,5) м3 )/ 290 К = ((1,5 - 105) Па х V2) / 279 К
279/290 х 1/1,5 м3 = V2
0,64 м3 = V2
Проверка закона Шарля
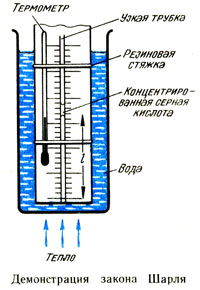 Прибор, используемый в этом исследовании (см. рис.), состоит из узкой трубки, закрытой с одного конца, внутрь которой помещена капля концентрированной серной кислоты. Присоедините эту трубку и термометр к шкале резиновыми стяжками и поместите их в высокий лабораторный стакан с водой, при этом открытый конец трубки должен быть сверху. Слегка подогрейте воду в лабораторном стакане. Капля серной кислоты поглощает водяные пары и обеспечивает сухость воздуха. В течение всего эксперимента давление воздуха, заключенного в трубке, постоянно и равно атмосферному давлению плюс давление, оказываемое серной кислотой. Снимите показания температуры и длины столбика воздуха при разностях температуры 10 °С. При этом предусмотрите следующее:
Прибор, используемый в этом исследовании (см. рис.), состоит из узкой трубки, закрытой с одного конца, внутрь которой помещена капля концентрированной серной кислоты. Присоедините эту трубку и термометр к шкале резиновыми стяжками и поместите их в высокий лабораторный стакан с водой, при этом открытый конец трубки должен быть сверху. Слегка подогрейте воду в лабораторном стакане. Капля серной кислоты поглощает водяные пары и обеспечивает сухость воздуха. В течение всего эксперимента давление воздуха, заключенного в трубке, постоянно и равно атмосферному давлению плюс давление, оказываемое серной кислотой. Снимите показания температуры и длины столбика воздуха при разностях температуры 10 °С. При этом предусмотрите следующее:
а) убирайте источник нагрева перед каждым снятием показаний, размешайте хорошо воду и оставьте прибор на короткое время, чтобы обеспечить равную температуру воды и воздуха в трубке;
б) всегда поддерживайте каплю серной кислоты ниже уровня воды в стакане.
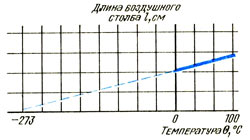 Поскольку площадь поперечного сечения трубки постоянна, то длина пропорциональна объему V, занимаемому воздухом. Постройте график зависимости длины I столбика воздуха и температуры Ɵ по Цельсию. Он будет похож на график зависимости давления от температуры Ɵ, а именно будет представлять собой прямую линию, пересекающую ось температур примерно на отметке - 273 °С. Если температуру выражать в Кельвинах, то график зависимости объема V (или длины I) от температуры Т будет представлять собой прямую линию, проходящую через начало координат, показывающую, что объем V пропорционален температуре по Кельвину Т.
Поскольку площадь поперечного сечения трубки постоянна, то длина пропорциональна объему V, занимаемому воздухом. Постройте график зависимости длины I столбика воздуха и температуры Ɵ по Цельсию. Он будет похож на график зависимости давления от температуры Ɵ, а именно будет представлять собой прямую линию, пересекающую ось температур примерно на отметке - 273 °С. Если температуру выражать в Кельвинах, то график зависимости объема V (или длины I) от температуры Т будет представлять собой прямую линию, проходящую через начало координат, показывающую, что объем V пропорционален температуре по Кельвину Т.
Пример
Цилиндр содержит газ объемом 20 л под давлением 25 х 105 Па. Клапан открывают до тех пор, пока давление не падает до 20 х 105 Па, а затем закрывают. Принимая температуру за постоянную, определите, каков будет объем высвобожденного газа, находящегося при атмосферном давлении (1 X 105) Па.
исходное давление p1 = 25 х 105 Па
исходный объем V1 = 20 л
конечное давление р2 = 1 х 105 Па
конечный объем V2 = ?
Полагая, что весь исходный газ расширяется, согласно закону Бойля
p1V1 = p2V2
(25 х 105) Па х 20 л = (1 х 105) Па х V2
((25 х 105 ) / (1 х 105)) х 20 л = V2
500 л = V2
Определяя тем же способом объем газа, оставшегося в цилиндре, получим 400 л при атмосферном давлении. Таким образом, объем высвобожденного газа при атмосферном давлении составляет 500 - 400 = 100 литров.
Этот пример показывает, почему удобно транспортировать газ под большим давлением. На банках с аэрозолями обычно пишется предупреждение, что они должны храниться в холодном месте, их не следует держать на прямом солнечном свете и даже пустые банки нельзя бросать в огонь. Так пишется потому, что банка содержит быстро испаряющуюся жидкость, и даже если распыление ее уже невозможно, все равно в банке остается немного жидкости.
Когда температура в банке поднимается, то происходит:
а) быстрое испарение жидкости, которое увеличивает число молекул газа на единицу объема банки;
б) увеличение скорости движения молекул.
Эти два фактора приводят к значительному повышению давления, которое может разорвать банку.







