
Новый Эталон Килограмма
может в ближайшее время заменить устаревший платиново-иридиевый... »»»

Солнце Становится Ближе
получены изображения высокого разрешения Солнца с космической обсерватории Solar Dynamics Observatory... »»»

Человек "Искрививший" Время
биография Альберта Эйнштейна - величайшего физика создавшего "Общую теорию относительности"... »»»

Что за Очки у Будущего?
история создания, развития и будущее популярного оптического прибора... »»»
Все вещества в разных условиях могут быть подразделены на три состояния: твердое, жидкое и газообразное. Всякое вещество состоит из молекул или атомов в различных энергетических состояниях.
Молекулы
Молекула какого-либо вещества — это наимельчайшая частица этого вещества, которая существует в обычных условиях и при этом сохраняет все признаки этого вещества.
Средняя цифра для размера t молекулы— порядка 1х10-9 м. Весьма трудно наблюдать размеры настолько малые, как 10-9 м. Это означает, что одна тысяча миллионов молекул, помещенных рядом, растянется вдоль однометровой линейки. Тысячу миллионов также почти невозможно представить. Эта цифра примерно представляет все население Индии, Китая, США и бывшего СССР.
Молекула может состоять из группы еще более малых частиц, называемых атомами. Например, молекула водорода (газа) состоит из двух атомов водорода, соединенных между собой.
Молекулы могут состоять из одного атома, как в инертном газе аргоне, из двух одинаковых атомов, соединенных вместе, как в случае с газом кислородом, или же из малой группы атомов, соединенных между собой, как в случае с водой, молекула которой состоит из одного атома кислорода и двух атомов водорода. Очень большие группы атомов тоже могут соединяться друг с другом, образуя полимеры, и т. д.
Атомы
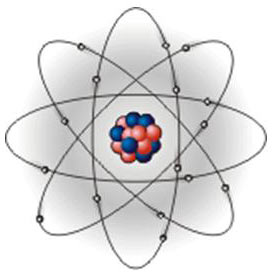
Сами атомы по современным представлениям состоят из трех основных частиц: протонов, нейтронов и электронов. (Существует много других атомных и субатомных частиц, но их рассмотрение выходит за рамки этой книги.) Модель атома можно представить следующим образом: в маленькой сердцевине атома находится ядро, в котором ядерными силами удерживаются протоны и нейтроны; вокруг ядра по своим орбитам вращаются электроны, похожие на планеты, обращающиеся вокруг Солнца. 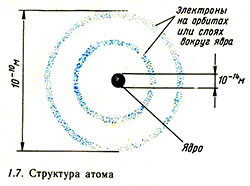 Каждый протон несет на себе заряд, равный по модулю электрическому заряду электрона, но противоположный по знаку, поскольку электроны несут на себе отрицательные заряды. Нейтроны нейтральны или не заряжены. Частицы, формирующие ядро, т. е. протоны и нейтроны, известны под общим названием нуклоны. Масса электрона составляет 9,1х10-31кг — невероятно малая масса. Весьма небольшая сила, действующая на электрон, может ускорять его до фантастически высоких скоростей. Масса протона почти такая же, как и масса нейтрона, и примерно в 1840 раз больше массы электрона. Таким образом, масса атома практически полностью сконцентрирована в ядре атома и практически равна массе его нуклонов, т. е. сумме масс нуклонов (протонов и нейтронов), которые составляют ядро.
Каждый протон несет на себе заряд, равный по модулю электрическому заряду электрона, но противоположный по знаку, поскольку электроны несут на себе отрицательные заряды. Нейтроны нейтральны или не заряжены. Частицы, формирующие ядро, т. е. протоны и нейтроны, известны под общим названием нуклоны. Масса электрона составляет 9,1х10-31кг — невероятно малая масса. Весьма небольшая сила, действующая на электрон, может ускорять его до фантастически высоких скоростей. Масса протона почти такая же, как и масса нейтрона, и примерно в 1840 раз больше массы электрона. Таким образом, масса атома практически полностью сконцентрирована в ядре атома и практически равна массе его нуклонов, т. е. сумме масс нуклонов (протонов и нейтронов), которые составляют ядро.
Типичными значениями для диаметра ядра и диаметра атома являются 10-14 м и 10-10 соответственно (рис. 1.7), т. е. диаметр атома примерно в 10 000 раз больше диаметра ядра. Наименьшим известным атомом является атом водорода (рис. 1.8, а); 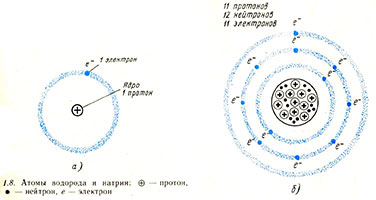 он же является единственным атомом, в ядре которого нет нейтронов. Некоторое представление о соотношении размеров ядра и орбиты электрона в атоме водорода дает следующее сравнение: если протон представить по размеру, равным Лондону, то электрон будет вращаться по орбите с радиусом, равным расстоянию от Лондона до Ньюкасла и Парижа при условии, что между этими городами ничего нет. Итак, большая часть объема атома свободна.
он же является единственным атомом, в ядре которого нет нейтронов. Некоторое представление о соотношении размеров ядра и орбиты электрона в атоме водорода дает следующее сравнение: если протон представить по размеру, равным Лондону, то электрон будет вращаться по орбите с радиусом, равным расстоянию от Лондона до Ньюкасла и Парижа при условии, что между этими городами ничего нет. Итак, большая часть объема атома свободна.
В нейтральном атоме должно быть равное число протонов и электронов, так, чтобы электрические заряды взаимно уничтожались. Рисунок 1.8,6 демонстрирует нейтральный атом натрия, электроны которого показаны на электронных оболочках. Если нейтральный атом теряет электрон, то остальная часть атома, называемая ионом, приобретает положительный заряд. Ион — это любая заряженная частица, обычно состоящая из атома (или группы атомов), который или потерял, или приобрел один или больше электронов. Электроны, будучи отрицательно заряженными частицами, сами могут рассматриваться как отрицательные ионы.







