Новый Эталон Килограмма
может в ближайшее время заменить устаревший платиново-иридиевый... »»»

Солнце Становится Ближе
получены изображения высокого разрешения Солнца с космической обсерватории Solar Dynamics Observatory... »»»

Человек "Искрививший" Время
биография Альберта Эйнштейна - величайшего физика создавшего "Общую теорию относительности"... »»»

Что за Очки у Будущего?
история создания, развития и будущее популярного оптического прибора... »»»
 Атом — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Атом — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Протоны
Протон имеет массу примерно 1 а.е.м. и заряд +e. Это — ядро водорода. Его заряд равен и противоположен заряду электрона, а его масса примерно в 2000 раз больше. Когда а-частицы бомбардируют азот, то испускаются протоны. Поскольку протон меньше а-частицы, то он обладает большей проникающей способностью. Он отклоняется и магнитным, и электрическим полями, так как он электрически заряжен.
Нейтроны
Нейтрон был открыт в 1930 г., когда подвергли бомбардировке а-частицами бериллий. Была обнаружена проникающая радиация, которая могла проходить через'слои свинца довольно большой толщины (примерно 10 см). Это излучение.не отклоняется электрическим и магнитным полями, поэтому пришли к выводу, что оно не имеет заряда. Энергия излучения указывала на малую вероятность того, что оно является электромагнитным. Дальнейшие эксперименты показали, что масса нейтрона примерно равна массе протона.
Структура атома
После открытия нейтрона предположили, что ядро атома состоит из протонов и нейтронов. Протоны и нейтроны иногда называют нуклонами. Таким образом, стали считать, что в состав атома входит ядро из протонов и нейтронов, окруженное отрицательно заряженными электронами, которые могут находиться на определенных энергетических уровнях. Поскольку атом электрически нейтрален, то число электронов, окружающих ядро, должно быть равно числу протонов в ядре. (Электрический нейтральный означает, что частица либо совсем не несет заряда, либо несет равные количества положительного и отрицательного зарядов, так что любые действующие на заряды силы (магнитные и электрические) будут равны и противоположны и поэтому будут взаимоуничтожаться.) Практически вся масса атома содержится в его ядре. Диаметр ядра составляет примерно 10“15 м, а всего атома 10“10 м. Ясно, что так называемые твердые тела содержат очень много пустого пространства!
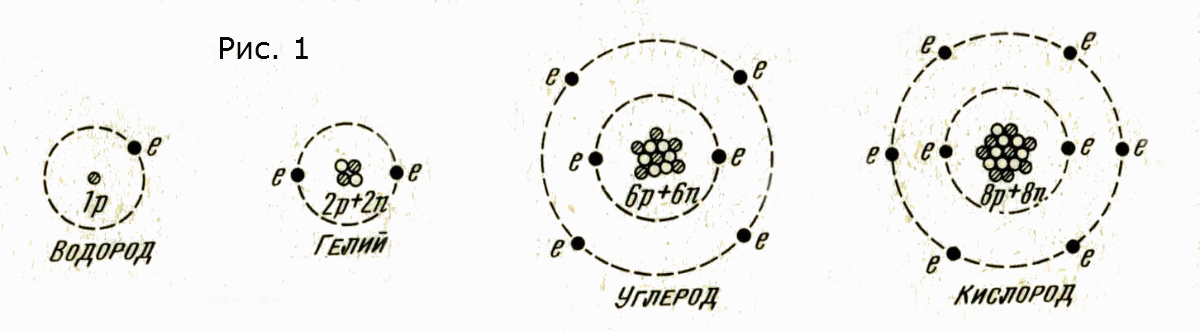
Рисунок 1 представляет атом водорода 11Н, гелия 24Не, углерода 612С и кислорода 816О. Верхнее число А (4 для гелия) — нуклонное число, ранее называвшееся массовым числом, представляет собой число нуклонов (протоны плюс нейтроны) в ядре. Нижнее число Z (2 для гелия) является протонным числом, ранее называвшимся атомным числом, представляет собой число протонов (положительных зарядов) в ядре. Это будет и числом электронов вокруг ядра. А—Z равно числу нейтронов в ядре. Применяя эти обозначения, частицы можно представить следующим образом: альфа 24Не, бета протон -10Н и нейтрон 01n. Гамма-лучи не имеют ни массы, ни заряда, но зато обладают энергией, потому что они являются электромагитными волнами.
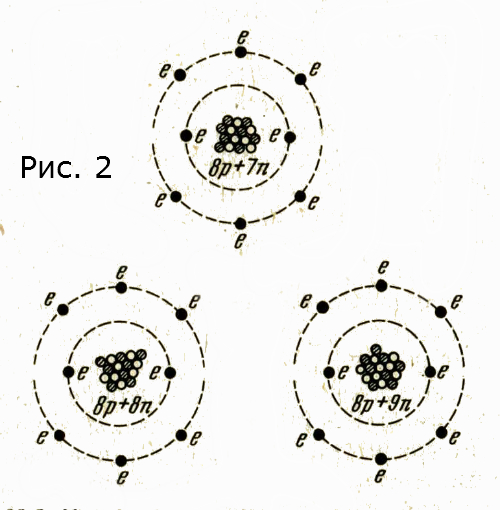
Изотопы.
За исключением водорода число протонов в каждом ядре атомов, показанных на рисунке 1, равно числу нейтронов. Это не всегда так. Более тяжелые элементы, например, в ядре содержат больше нейтронов, чем протонов. Отдельный элемент может существовать в различных формах. Все частицы, изображенные на рисунке 2, имеют одинаковое число протонов в ядрах и одинаковое число внешних электронов. Поскольку химические свойства элемента зависят от числа внешних электронов, то все они представляют собой частицы одного и того же элемента, а именно кислорода. Вместе с тем каждая из них имеет различное число нуклонов. Они называются изотопами кислорода. Изотопами являются вещества с одинаковыми протонными числами, но с различными нуклонными числами, химически они не могут быть разделены. Они могут быть разделены физически, еслцсначала подвергнутся ионизации, а затем отклонению в сильном магнитном поле (при помощи масс-спектрографа). Поскольку их заряды одинаковы, то на них действует одинаковая сила, но, ввиду того что их масса различна, они отклоняются в разной степени. Природные вещества часто состоят из смеси изотопов.