
Новый Эталон Килограмма
может в ближайшее время заменить устаревший платиново-иридиевый... »»»

Солнце Становится Ближе
получены изображения высокого разрешения Солнца с космической обсерватории Solar Dynamics Observatory... »»»

Человек "Искрививший" Время
биография Альберта Эйнштейна - величайшего физика создавшего "Общую теорию относительности"... »»»

Что за Очки у Будущего?
история создания, развития и будущее популярного оптического прибора... »»»
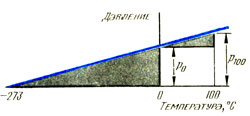 Расширение газов происходит сложно, потому что могут изменяться и давление газа, и объем. Поэтому обычно сохраняют постоянным или объем, или давление. Если объем постоянен, то может быть введен термический коэффициент давления. Определение термического коэффициента давления при расширении можно описать формулой:
Расширение газов происходит сложно, потому что могут изменяться и давление газа, и объем. Поэтому обычно сохраняют постоянным или объем, или давление. Если объем постоянен, то может быть введен термический коэффициент давления. Определение термического коэффициента давления при расширении можно описать формулой:
Два треугольника на графике давления (см. рис.) подобны, поэтому р0/273 = (p100 – p0)/ 100 или 1/273 = (p100 – p0) / (p0 х 100) и термический коэффициент давления составляет 1/273 К-1.
Нетрудно будет получить тот же результат для коэффициента объемного расширения при постоянном давлении по графику объем — температура. Итак, значение коэффициента объемного расширения равно термическому коэффициенту давления. Более того, если применяются разные газы, то это значение одинаково для всех газов. В этом состоит коренное отличие газов от твердых тел и жидкостей, которые имеют разные коэффициенты объемного расширения. Это также предполагает наличие фундаментальных признаков поведения всех газов. Данное соображение важно для тех, кто изучает физику на более высоком уровне.
Расширение газов
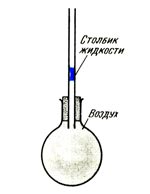 Расширение газа значительно больше расширения жидкости при одинаковом росте температуры. Воздух расширяется в 3 раза больше спирта и в 10 раз больше, чем вода. Если вы подержите в руках колбу с воздухом, изображенную на рисунке, то столбик жидкости выскочит через верх трубки, показывая этим, что воздух расширился.
Расширение газа значительно больше расширения жидкости при одинаковом росте температуры. Воздух расширяется в 3 раза больше спирта и в 10 раз больше, чем вода. Если вы подержите в руках колбу с воздухом, изображенную на рисунке, то столбик жидкости выскочит через верх трубки, показывая этим, что воздух расширился.
Газы всегда занимают все доступное им пространство, и когда вы имеете дело с их расширением, то условия их содержания должны быть предусмотрены со всей тщательностью.
Более подробно о давлениее в газах вы можете узнать из видео ниже.







