
Новый Эталон Килограмма
может в ближайшее время заменить устаревший платиново-иридиевый... »»»

Солнце Становится Ближе
получены изображения высокого разрешения Солнца с космической обсерватории Solar Dynamics Observatory... »»»

Человек "Искрививший" Время
биография Альберта Эйнштейна - величайшего физика создавшего "Общую теорию относительности"... »»»

Что за Очки у Будущего?
история создания, развития и будущее популярного оптического прибора... »»»
 Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Химическое действие электрического тока
Ранее мы писали, что э.д.с. образуется, когда в соприкосновение приходят различные вещества. Обоснованным было бы заключить, что, когда через раствор проходит электрический заряд, происходят химические преобразования. Это может быть подтверждено при помощи вольтаметра Гоффмана (рис. 1).
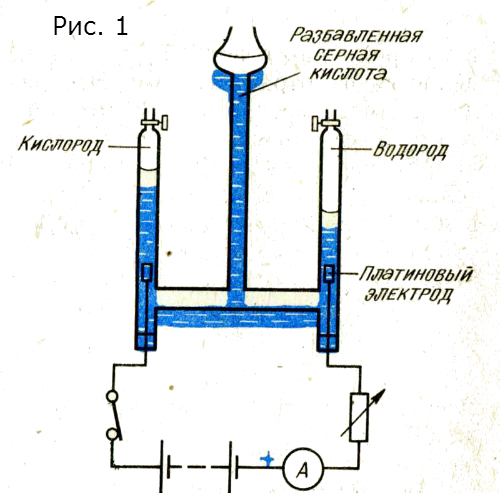
Электроды вольтаметра сделаны из платины, а электролитом является вода, к которой добавлено несколько капель серной кислоты. Электрод, который подсоединен к положительному выводу батареи, называется анодом; электрод, присоединенный к отрицательному выводу батареи, называется катодом. Когда замыкается ключ, через электролит идет ток и на обоих электродах выделяются газы. Газ, который выходит, когда крышка на аноде открыта, даст яркую вспышку в пламени, показывая, что это кислород. Если держать открытое пламя над крышкой катода и открыть ее, то выходящий газ воспламенится с «хлопком» и будет гореть голубым пламенем. Этот газ — водород. Объем освобождаемого водорода в 2 раза больше объема кислорода.
В электролите присутствуют положительные ионы водорода (Н + ), отрицательные ионы сульфата (S042¯) и отрицательные ионы гидроксила (ОН¯). Ионы водорода переходят к катоду, где их положительный заряд нейтрализуется электронами, и высвобождается водород. На аноде ионы гидроксила теряют свои электроны и комбинируются, образуя воду и кислород. Выделяется кислород. Ионы сульфата остаются в растворе.
Что бы наблюдалось, если бы был использован источник переменного тока? Каждый электрод был бы попеременно катодом и анодом. Газы по- прежнему выделялись бы на обоих электродах, но это была бы смесь двух газов. В экспериментах с электролизом важно иметь источник постоянного тока.
В простом элементе водород выделяется на положительном электроде, в то время как в вольтаметре он выделяется на отрицательном. Это различие имеет место, потому что заряд течет внутри простого элемента и ток направлен здесь в сторону положительной пластины, в это же время в вольтаметре ток направлен в сторону отрицательной пластины во внешней цепи. Итак, водород всегда выделяется на пластине, к которой направлен положительный заряд.
Электролиз в растворе сульфата меди (II)
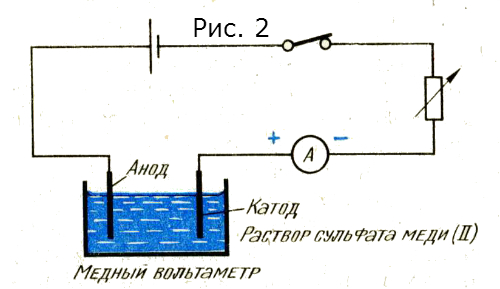
На рисунке 2 показан медный вольтаметр.
Анод и катод здесь — это медные пластины, а электролитом является раствор сульфата меди (II). Когда создается ток, медь откладывается на катоде, а анод теряет.массу. Концентрация раствора остается неизменной, потому что отрицательные ионы сульфата, достигая анода, отдают свои электроны и взаимодействуют с медью анода, образуя молекулы сульфата меди.
Если используются платиновые электроды, медь по-прежнему откладывается на катоде. Реакция на аноде отличается тем, что высвобождается кислород и образуется вода, но не образуются молекулы сульфата меди (II). Таким образом, концентрация раствора уменьшается.
Основные факты, касающиеся электролиза
1. Водород и металлы всегда выделяются на катоде.
2. Выделенная на катоде масса вещества пропорциональна перемещенному заряду, т. е. m ~ Q (It). Эта масса не зависит от площади пластин, а зависит лишь от силы тока и времени, в течение которого заряд проходит через электролит.
3. Выделенная масса вещества зависит от относительной атомной массы и валентности вещества.
4. Необходим источник постоянного тока.







